
药品成分荧光素钠。化学名称:9-(邻羧基苯基)-6-羟基-3H-呫吨-3-酮二钠盐。化学结构式:分子式:C20H10Na2O5分子量:376.28功能主治诊断用药。供诊断眼角膜损伤、溃疡和异物,眼底血管造影和循环时间测
【药品名称】
通用名称:荧光素钠注射液
英文名称:Fluorescein Sodium Injection
汉语拼音:Yingguangsuna Zhusheye
【成 份】荧光素钠。
化学名称: 9-(邻羧基苯基)-6-羟基-3H-呫吨-3-酮二钠盐。
化学结构式: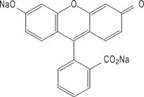
分子式:C20H10Na2O5
分子量:376.28
【性 状】本品为橙红色澄明液体。
【适 应 症】诊断用药。供诊断眼角膜损伤、溃疡和异物,眼底血管造影和循环时间测定。也用
于术中显示胆囊和胆管,以及结核性脑膜炎的辅助诊断等。
【规 格】 3ml︰0.6g
【用法用量】
1.循环时间测定 前臂静脉注射,成人常用量5ml(10%)。小儿常用量,按体重0.05ml/kg(10%),全量在1秒内快速推入。
2.眼底血管造影 静脉注射,成人常用量5ml(10%),或按体重15~30mg/kg计算,全量在4秒左右推注完毕,注射后8秒开始在蓝色光波激发下用荧光眼底照相机连续摄影,开始每秒1张,连续10秒,以后在30分钟内适当间隔摄片,也可用眼底镜直接观察。
3.术中显示胆囊和胆管 手术前4小时静脉注射5ml(10%)。
4.脑脊液渗透率试验(诊断结核性脑膜炎)肌内注射,成人推荐用量5~10ml(10%)。儿童推荐用量按体重0.3ml/kg(10%),注射后2小时腰椎穿刺抽取脑脊液,与浓度为0.00001%、
0.00002%、0.00003%、0.00005%、0.00006%、0.0001%、0.0002%和0.0005%的标准系列比色管比色。
【不良反应】
1.过敏反应:包括荨麻疹、呼吸困难、哮喘发作、呼吸停止、血压下降、休克、心脏停搏、
心肌梗死、肺水肿和脑梗死等。
2.常见恶心、呕吐、眩晕,多在注射后30秒钟内发生。反应发生率和严重程度与注射液浓度和注入量有关。一次静脉注入量超过5ml(5%),常可出现恶心和呕吐症状。
3.静脉注射后皮肤和尿液暂时染色,视物有黄色或粉红色感觉。
4.本品血管造影时总的反应发生率约0.6%,严重反应约0.4%。肌内注射后可有局部疼痛。
【禁 忌】
1.对本品过敏者禁用。
2.有哮喘史和其他过敏性疾病者禁用。
3.严重肝、肾功能不全者禁用。
4.测血循环时,先天性缺血性心脏病患者及及妊娠期妇女患者禁用。
【注意事项】
1.在使用前,以肉眼对本品进行检查,如发现安瓿瓶有破裂、药液有颗粒物或包装异常,则不可用。
2.本品为荧光素钠的灭菌水溶液,荧光素钠收载于《中国药典》2015年版二部,该品种项下有氯化物检查项的限度要求,提示氯化物可能会引起本品安全性风险。本品浓度为20%,使用时可用灭菌注射用水稀释成10%浓度,不建议使用氯化钠注射液及其他溶媒。
3.慎用:(1)高血压、糖尿病患者。(2)脑动脉硬化患者。(3)病后体质虚弱者。(4)药物
对哺乳有影响,本药可随乳汁分泌,哺乳期妇女应慎用。
4.少数患者对本品可发生过敏反应。建议在静脉给药前10~15分钟先用1%的本品溶液5ml注入静脉做过敏试验,若无反应再全量推入。在推注本品和给药后数小时内应严密观察患者反应。现场应备有急救药品和器材,包括静脉或肌肉注射用的0.1%肾上腺素、抗组胺药、皮质炎固醇注射液,静脉注射用的氨茶碱等以及供氧设施,以备注射荧光素钠后发生严重不良反应时用。
5.本品忌与酸、酸式盐和重金属盐类混合使用。
6.注射剂注意勿漏出血管外,否则可致剧烈疼痛。
7.对诊断的干扰 本品静脉或肌内注射后,可暂时影响需观察血清、尿液颜色或进行比色测定的各项实验室检查结果。
8.本品不可与亲水性软接触镜接触,否则镜片会染色。
9.荧光素染料在暗室用紫外线或蓝色光激发可发生绿色荧光,更易观察。
10.本品易受铜绿假单胞菌污染。
11.眼底血管造影前宜先扩瞳,并做眼底检查,了解检查部位。
【孕妇及哺乳期妇女用药】测血循环时,孕妇禁用。
【儿童用药】尚不明确。
【老年用药】尚不明确。
【药物相互作用】
1.在静脉注射本品前30分钟服用甲氧氯普胺(胃复安)10mg和抗组胺药物,有助于减少恶心、呕吐反应。
2.本品忌与酸、碱式盐和重金属盐混合使用。
【药物过量】尚不明确。
【药理毒理】药理作用 本品为诊断用药,是一种染料,对正常角膜等上皮不能染色,但能对损伤的角膜上皮染成绿色,从而可显示出角膜损伤、溃疡等病变。
本品流经小血管时,能在紫外线或蓝色光激发下透过较薄的血管壁和黏膜呈现绿色荧光,从而显示小血管行经和形态等,据此可供眼底血管造影和循环时间测定。
本品几乎不能透过血脑屏障,但在结核性脑膜炎时脑脊液内含量有所增加,肌内注射后测定脑脊液内本品含量有助于对结核性脑膜炎的诊断和鉴别诊断。
【药代动力学】成人肌内注射0.5~1g后2小时脑脊液内含量低于0.00002%。静脉注射后约60%与血浆白蛋白结合。
本品在体内不参与代谢,也不与组织牢固结合。主要经肾脏从尿液中排出,小部分经肝从胆汁排出,24小时内从体内基本排尽。
【贮 藏】密闭保存。
【包 装】中硼硅玻璃安瓿包装,每盒5支。
【有 效 期】24个月
【执行标准】《中国药典》2020年版二部
【批准文号】国药准字H45021477
【上市许可持有人】广西梧州制药(集团)股份有限公司
地 址:广西梧州工业园区工业大道1号
【生产企业】
企业名称:广西梧州制药(集团)股份有限公司
生产地址:广西梧州工业园区工业大道1号
邮政编码:543002
电话号码:(0774)3939080
传真号码:(0774)3939090
网 址:www.wz-zhongheng-zy.com